
Mucopolisacaridosis (MPS) IV, o síndrome de Morquio, es una enfermedad de almacenamiento lisosomal multisistémica y progresiva que resulta de una deficiencia de las enzimas N-acetilgalactosamina 6-sulfatasa o β-galactosidasa, responsables del catabolismo de glicosaminoglicanos (GAGs),2 que están implicados en la formación de hueso, cartílago, piel, tendones, y muchos otros tejidos del organismo.3 Se reconocen dos formas distintas: tipo A (MPS IVA, Morquio A) y tipo B (MPS IVB). Estos tipos difieren en la causa genética de la enfermedad, pero los signos y síntomas entre estas forma pueden ser similares y estar presentes en todo el espectro de progresión de la enfermedad.4
MPS IV es progresiva, sistémica y de por vida, y puede llevar a morbilidad sistémica y a menos años de vida.
El hecho de ser una enfermedad poco frecuente, con una presentación heterogénea y progresión variable hace que el diagnóstico sea un desafío y la intervención temprana, esencial.1,2 Independientemente del fenotipo, los síntomas pueden avanzar hasta causar daños irreversibles en órganos. Entre los factores de riesgo de mayor morbilidad encontramos los siguientes 4,5:
La mayoría de los pacientes con Morquio A no sobreviven después de la segunda década de vida, con frecuentes causas de muerte que incluyen insuficiencia respiratoria, complicaciones de la cirugía e insuficiencia cardíaca.1
Los pacientes con MPS IV, comúnmente percibida como un cuadro musculoesquelético,1 pueden presentar o desarrollar una sintomatología impredecible y clínicamente heterogénea que se extiende más allá de las manifestaciones obvias.6 La tabla a continuación muestra los potenciales signos y síntomas de Morquio A, que pueden observarse de manera aislada o en combinación con otros y que deben generar una sospecha de Morquio A.
Las manifestaciones progresivas y sistémicas pueden llevar a consecuencias cardiovasculares,1,7-9 pulmonares,1,6,7,10,11 neurológicas, 6,12 musculoesqueléticas,1,6 reumatológicas,5,13 oftalmológicas,1,14,15 ONG,1,16 hepáticas/abdominales13 y dentales,6,17 potencialmente severas. Sin embargo, a diferencia de otras enfermedades MPS, los pacientes con MPS IV no presentan deficiencias cognitivas.
Cabe destacar que más del 70% de los pacientes manifiestan rasgos esqueléticos inusuales dentro los 2 – 3 primeros años de vida.6 La investigación reciente ha indicado que alrededor del 25% de los pacientes con síndrome de Morquio A presenta un fenotipo no clásico.5
Los pacientes pueden presentar patrones clásicos y no clásicos de signos y síntomas. Los pacientes con fenotipo no clásico generalmente sufren una demora en el diagnóstico con relación a la manifestación de los síntomas.1
Progresión variable de la enfermedad en pacientes con Morquio A18

Independientemente del fenotipo,1 los síntomas pueden avanzar hasta causar un daño irreversible en los órganos.
Subestimar la presentación no clásica de Morquio A implica obtener un diagnóstico demorado, o ninguno, y sus impactos significativos:
Consideraciones quirúrgicas
La necesidad y carga quirúrgica es alta entre los pacientes con Morquio A. De acuerdo con un estudio acerca de la evolución natural de Morquio A, el 70% de la población (edad promedio 14,5 años) tuvo al menos 1 procedimiento quirúrgico .7
Incidencia de procedimientos quirúrgicos comunes para la población con Morquio A
La historia quirúrgica y la necesidad de los pacientes deben alertarle sobre la posibilidad de MPS IV.
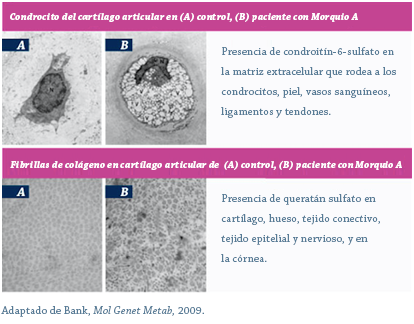
Morquio A y MPS IVB son causadas por mutaciones en los genes GALNS y GLB1, que codifican las enzimas N-acetilgalactosamina 6-sulfatasa y β-galactosidasa, respectivamente.1,25 Las deficiencias enzimáticas resultantes producen múltiples patologías metabólicas, incluyendo, como la más notoria, la acumulación de sustratos GAG queratán sulfato y condroitín-6-sulfato en los lisosomas en todo el organismo.1,26
A medida que los lisosomas se acumulan, éstos ocupan un área cada vez mayor en el citoplasma, oscureciendo otros orgánulos y alterando la función.27 La actividad de la enzima defectuosa en MPS IV genera disfunciones a nivel celular, de tejido, y órganos que resultan en la morbidez progresiva multisistémica característica de esta enfermedad.1,6
La investigación constante está transformando la atención de los pacientes:
Publicados en 2014, los Lineamientos Internacionales para la Atención y el Tratamiento del Síndrome de Morquio A establecen los estándares de cuidado para Morquio A. Debido a la naturaleza progresiva de la enfermedad, estos lineamientos urgen el inicio temprano del tratamiento con TRE.
Además de TRE, la atención continua de por vida y el cuidado de un equipo coordinado multidisciplinario son componentes críticos para optimizar los resultados en pacientes.6 El cuidado de apoyo incluye medicaciones e intervenciones quirúrgicas, que incluyen lo siguiente1,7:
Debido a la naturaleza impredecible y multisistémica de MPS IVA, también es fundamental la evaluación y el tratamiento regular, multidisciplinario, exhaustivo de un equipo de cuidado coordinado a fin de identificar signos de daños en órganos y asegurar óptimos resultados para los pacientes.1,6 Los médicos pueden optimizar su atención creando un plan de tratamiento personalizado para cada uno de sus pacientes, comenzando con un programa de evaluación completa para cada sistema corporal afectado por MPS IVA.1
Evaluaciones recomendadas por los lineamientos del 2014
Una vez confirmado el diagnóstico, se deben realizar las evaluaciones basales y se debe iniciar TRE de inmediato. La TRE puede mejorar la resistencia de manera significativa, según las mediciones del 6MWT. Un cambio significativo en 6MWT refleja un aumento o disminución de la función cardíaca, respiratoria y musculoesquelética y un cambio en la progresión de la enfermedad.1,26 Además de TRE, evaluaciones exhaustivas, tratamiento sintomático e intervenciones quirúrgicas,1,7 la atención continua desde el cuadro pediátrico hasta el del adulto es un aspecto crítico para los pacientes y familias que conviven con MPS.1,31
Los pacientes con MPS IV a menudo requieren intervenciones quirúrgicas debido a las complicaciones multisistémicas de la enfermedad.7 Esta atención quirúrgica es complicada por la naturaleza de la enfermedad.
Los pacientes con MPS IV se ven afectados por múltiples factores que pueden aumentar dramáticamente el riesgo quirúrgico y la necesidad de monitoreo 32:
Estos factores complican el cuidado quirúrgico y de la anestesia, requieren planeamiento y necesitan técnicas específicas de la enfermedad para optimizar los resultados.33
Los procedimientos perioperativos especializados durante la anestesia, tales como intubación y extubación, y el uso de una lista de verificación de neuromonitoreo intraoperativo son esenciales para una intervención quirúrgica exitosa.1,33 Es fundamental contar con un equipo quirúrgico integral formado por especialistas en MPS VI para obtener resultados duraderos y positivos.1
A medida que los pacientes con MPS IV alcanzan la adultez, la relación con el equipo médico se modifica. Esta transición requiere planes individuales para minimizar las interrupciones de tratamiento, extender la atención más allá del alcance de la atención pediátrica y soporte de los padres, y asegurar que los pacientes adultos sepan cómo tratar la MPS IV.1,31
Estos planes de transición deben ser elaborados a medida para cubrir las necesidades de cada paciente en particular, de modo que aquellos que puedan ocuparse de su propio cuidado posean las herramientas necesarias, y que aquellos que están más limitados cuenten con la atención y los servicios necesarios. Los planes deben también incluir una evaluación para determinar la capacidad del paciente para alcanzar sus metas definidas, así como también su conocimiento y capacidad para informar su estado de salud.31
References: 1. Hendriksz CJ, Berger KI, Giugliani R, et al. International guidelines for the management and treatment of Morquio A syndrome. Am J Med Genet Part A. 2014;9999A:1-15. doi:10.1002/ajmg.a.36833. 2. Northover H, Cowie RA, Wraith JE. Mucopolysaccharidosis type IVA (Morquio syndrome): a clinical review. J Inherit Metab Dis. 1996;19(3):357-365. 3. Islam T, Linhardt RJ. Chemistry, biochemistry, and pharmaceutical potentials of glycosaminoglycans and related saccharides. In: Wong C-H, ed. Carbohydrate-based Drug Discovery. Weinheim, Germany: WILEY-VCH Verlag GmbH & Co KGaA; 2003:407-439. 4. Tomatsu S, Montaño AM, Nishioka T, et al. Mutation and polymorphism spectrum of the GALNS gene in mucopolysaccharidosis IVA (Morquio A). Hum Mutat. 2005;26(6):500-512. 5. Montaño AM, Tomatsu S, Gottesman GS, Smith M, Orii T. International Morquio A Registry: clinical manifestation and natural course of Morquio A disease. J Inherit Metab Dis. 2007;30(2):165-174. doi:10.1007/s10545-007-0529-7. 6. Tomatsu S, Montaño AM, Oikawa H, et al. Mucopolysaccharidosis type IVA (Morquio A disease): clinical review and current treatment: a special review. Curr Pharm Biotechnol. 2011;12(6):931-945. doi:1389-2010/11. 7. Harmatz P, Mengel KE, Giugliani R, et al. The Morquio A clinical assessment program: baseline results illustrating progressive, multisystemic clinical impairments in Morquio A subjects. Mol Genet Metab. 2013;109(1):54-61. doi:10.1016/j.ymgme.2013.01.021. 8. John RM, Hunter D, Swanton RH. Echocardiographic abnormalities in type IV mucopolysaccharidosis. Arch Dis Child. 1990;65(7):746-749. 9. Ireland MA, Rowlands DB. Mucopolysaccharidosis type IV as a cause of mitral stenosis in an adult. Br Heart J. 1981;46(1):113-115. 10. Semenza GL, Pyeritz RE. Respiratory complications of mucopolysaccharide storage disorders. Medicine. 1988;67(4):209-219. 11. Pelley CJ, Kwo J, Hess DR. Tracheomalacia in an adult with respiratory failure and Morquio syndrome. Respir Care. 2007;52(3):278-282. 12. Gulati MS, Agin MA. Morquio syndrome: a rehabilitation perspective. J Spinal Cord Med. 1996;19(1):12-16. doi:10.1159/000202621. 13. Holzgreve W, Gröbe H, von Figura K, Kresse H, Beck H, Mattei JF. Morquio syndrome: clinical findings in 11 patients with MPS IVA and 2 patients MPS IVB. Hum Genet. 1981;57(4):360-365. 14. Danes BS. Corneal clouding in the genetic mucopolysaccharidoses: a cell culture study. Clin Genet. 1973;4(1):1-7. 15. Leslie T, Siddiqui MAR, Aitken DA, Kirkness CM, Lee WR, Fern AI. Morquio syndrome: electron microscopic findings [letter]. Br J Ophthalmol. 2005;89(7):917-929. doi:10.1136/bjo.2004.055400. 16. Hendriksz CJ, Harmatz P, Beck M, et al. Review of clinical presentation and diagnosis of mucopolysaccharidosis IVA. Mol Genet Metab. 2013;110:54-64. doi:10.1016/j.ymgme.2013.04.002. 17. Kinirons MJ, Nelson J. Dental findings in mucopolysaccharidosis type IV A (Morquio's disease type A). Oral Surg Oral Med Oral Pathol. 1990;70(2):176-179. 18. Data on file. BioMarin Pharmaceutical Inc. 19. Berger KI, Fagondes SC, Giugliani R, et al. Respiratory and sleep disorders in mucopolysaccharidosis. J Inherit Metab Dis. 2013;36(2):201-210. doi:10.1007/s10545-012-9555-1. 20. Hendriksz C. Improved diagnostic procedures in attenuated mucopolysaccharidosis. Br J Hosp Med. 2011;72(2):91-95. 21. Clarke LA. Pathogenesis of skeletal and connective tissue involvement in the mucopolysaccharidoses: glycosaminoglycan storage is merely the instigator. Rheumatology (Oxford). 2011;50(suppl 5):v13-18. doi:10.1093/rheumatology/ker395. 22. Lehman TJA, Miller N, Norquist B, Underhill L, Keutzer J. Diagnosis of the mucopolysaccharidoses. Rheumatology. 2011;50(suppl 5):v41-v48. 23. Morishita K, Petty RE. Musculoskeletal manifestations of mucopolysaccharidoses. Rheumatology. 2011;50(suppl 5):v19-v25. doi:10.1093/rheumatology/ker397. 24. Muenzer J. Overview of the mucopolysaccharidoses. Rheumatology (Oxford). 2011;50(suppl 5):v4-v12. doi:10.1093/rheumatology/ker394. 25. Wood TC, Harvey K, Beck M, et al. Diagnosing mucopolysaccharidosis IVA. J Inherit Metab Dis. 2013;36(2):293-307. doi:10.1007/s10545-013-9587-1. 26. VIMIZIM [package insert]. Novato, CA: BioMarin Pharmaceutical Inc; 2014. 27. Coutinho MF, Lacerda L, Alves S. Glycosaminoglycan storage disorders: a review. Biochem Res Int. 2012;2012:471325. doi:10.1155/2012/471325. 28. Bank RA, Groener JEM, van Gemund JJ, et al. Deficiency in N-acetylgalactosamine-6-sulfate sulfatase results in collagen perturbations in cartilage of Morquio syndrome A patients. Mol Genet Metab. 2009;97(3):196-201. doi:10.1016/j.ymgme.2009.03.008. 29. Monzon ME, Casalino-Matsuda SM, Forteza RM. Identification of glycosaminoglycans in human airway secretions. Am J Respir Cell Mol Biol. 2006;34(2):135-141. doi:10.1165/rcmb.2005-0256OC. 30. Harmatz P, Mengel KE, Giugliani R, et al. Longitudinal analysis of endurance and respiratory function from a natural history study of Morquio A syndrome. Mol Genet Metab. 2015;114(2):186-194. doi:10.1016/j.ymgme.2014.10.015. 31. American Academy of Pediatrics, American Academy of Family Physicians, American College of Physicians, Transitions Clinical Report Authoring Group, Cooley WC, Sagerman PJ. Supporting the health care transition from adolescence to adulthood in the medical home. Pediatrics. 2011;128(1):182-200. doi:10.1542/peds.2011-0969. 32. Walker R, Belani KG, Braunlin EA, et al. Anaesthesia and airway management in mucopolysaccharidosis. J Inherit Metab Dis. 2013;36(2):211-219. doi:10.1007/s10545-012-9563-1. 33. Theroux MC, Nerker T, Ditro C, Mackenzie WG. Anesthetic care and perioperative complications of children with Morquio syndrome. Paediatr Anaesth. 2012;22(9):901-907. doi:10.1111/j.1460-9592.2012.03904.x.